バイオ医薬品と、後続品であるバイオシミラーの基礎知識を紹介します。バイオ医薬品と化学合成医薬品の違いについても確認しましょう。
バイオ医薬品、バイオシミラーとは
●バイオ医薬品:遺伝子組み換え技術、 細胞培養技術を用いた医薬品
● バイオシミラー:特許が切れたあとに販売されるバイオ医薬品
バイオシミラーは、 バイオ医薬品の一部
バイオ医薬品とは、遺伝子組み換え技術や細胞培養技術を用いて製造したタンパク質を有効成分とする医薬品のことです¹(詳しくは、引用文献1を参照)。
すべての医薬品は国から許可を得て製造・販売されており、特許を取得しているため、製造承認後一定の期間は他社では製造することができません。
バイオシミラーとは、先発のバイオ医薬品の特許が切れたあとに販売されるバイオ医薬品のことでバイオ後続品とも呼ばれます。
バイオシミラーという呼び方は、バイオ医薬品とシミラー(「類似」「似たようなもの」という英語)とを組み合わせてつくられました。現在では、世界的に統一した呼称になっています。
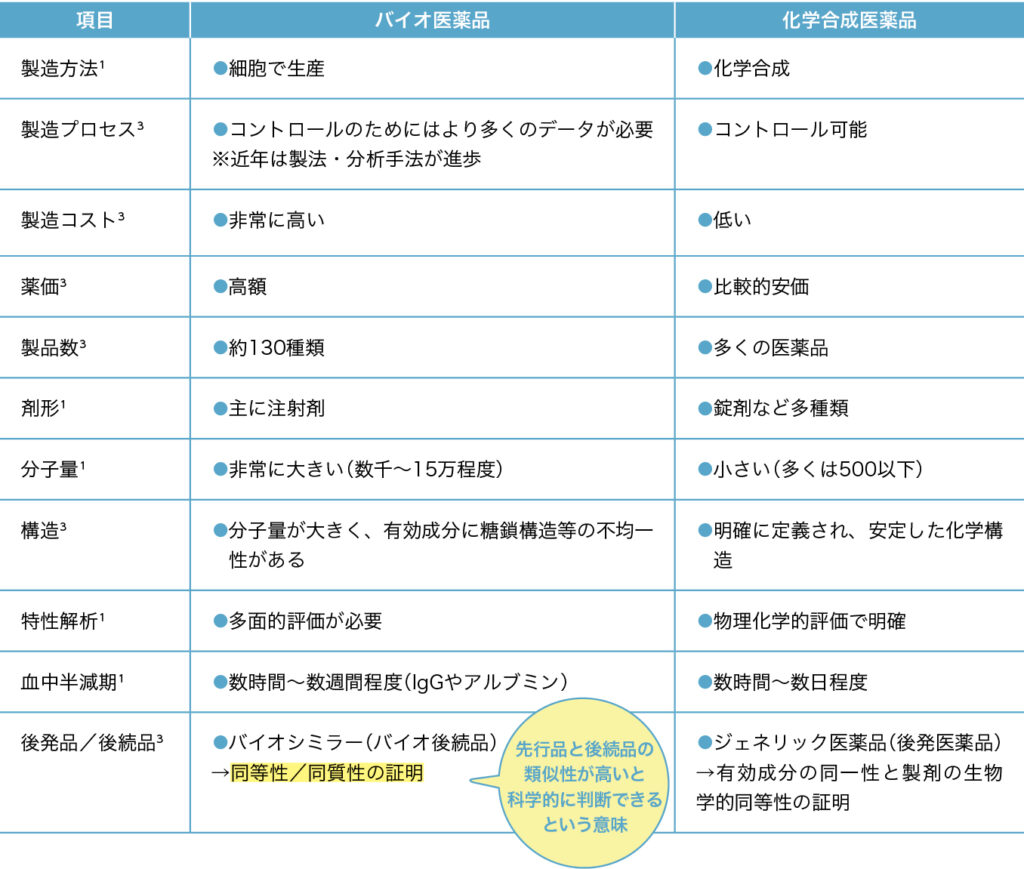
バイオ医薬品は、 化学合成医薬品と比べると「コスト・薬価が高く、 分子量が大きい」
バイオ医薬品と化学合成医薬品(低分子のものが多いことから低分子医薬品と呼ばれることもある)の違いを表1にまとめました。
主な違いを解説するとバイオ医薬品は、「製造方法で細胞を用いる」「製造コストが高い」「高額な薬価であるものが多い」「分子量が非常に大きく、数千から15万程度である」ことが挙げられます。
バイオ医薬品の後続品であるバイオシミラーと、特許が切れたあとに販売される化学合成医薬品であるジェネリック医薬品の違いも、先発品と同様に説明できます。
表1のなかで、バイオシミラーの項にある「同等性/同質性の証明」という部分が、わかりにくいと思われます。これについて、厚生労働省医薬・生活衛生局医薬品審査管理課長通知「『バイオ後続品の品質・安全性・有効性確保のための指針』について」(薬生薬審発0204第1号、令和2年2月4日)には、以下のように記載されています²。
「同等性/同質性」とは、先行バイオ医薬品とバイオ後続品の品質特性の類似性が高く、品質特性に何らかの差異が見出されたとしても、製造販売する製品の臨床的有効性・安全性に影響を及ぼすものではないことが、非臨床試験、臨床試験等の結果に基づいて科学的に判断できることを意味する。
※引用文献内、強調は編集部による
- 1.石井明子,若林進監修:これだけは知っておきたいバイオ医薬品.:1-2.
https://www.rad-ar.or.jp/finder/knowledge/whats_bio_pro.pdf(2024.8.2アクセス)
2.厚生労働省医薬・生活衛生局:医薬品審査管理課長通知・「バイオ後続品の品質・安全性・有効性確保のための指針」について(薬生薬審第0204第1号、令和2年2月4日).
https://www.mhlw.go.jp/web/t_doc?dataId=00tc4737&dataType=1&pageNo=1(2024.8.2アクセス)
3.日本バイオシミラー協議会ホームページ.
https://www.biosimilar.jp/index.html(2024.8.2アクセス)
この記事は『エキスパートナース』2021年9月号の記事を再構成したものです。
当サイト内の文章・画像等の内容の無断転載および複製等の行為を禁じます。
個々の患者の治療開始前には、医師・薬剤師とともに添付文書およびガイドライン等を確認してください。実践によって得られた方法を普遍化すべく万全を尽くしておりますが、万一、本誌の記載内容によって不測の事故等が起こった場合、著者、出版社、製薬会社は、その責を負いかねますことをご了承ください。





